- Неизвестная история
- Элементы таблицы Менделеева
- Щелочные и щелочноземельные элементы
- Лантаниды (редкоземельные элементы) и актиниды
- Галогены и благородные газы
- Переходные металлы
- Металлоиды
- Постпереходными металлами
- Олово при низких температурах
- Области применения олова
- Электронная схема олова
- Свойства Sn
- Аллотропные свойства олова
- Маркировка металла
- Свойства атома олова :
- Достоинства / недостатки
- Характеристика и физические свойства олова
- Особенности структуры, состав и технология производства олова
- Типы
- Преобладающие формы
- Степень окисления олова
- История открытия и изучения
- Кристаллическая решётка олова:
- Касситерит
- КЛАССИФИКАЦИЯ
- Месторождения оловянных руд
- Группы и периоды Периодической системы
- Общие сведения:
- ЗАПАСЫ И ДОБЫЧА
- ПРИМЕНЕНИЕ
- Минерал Станнин
- Валентность Sn
- ПРОИСХОЖДЕНИЕ
- Сплавы
- Плюсы и минусы олова
- Квантовые числа Sn
- Производство изделий из олова и его сплавов
- Простая консервная банка и гибель полярной экспедиции
- Энергия ионизации
- Силикаты
- Формирование и виды осадочных пород
- Промышленное получение
- Нахождение в природе
- Минеральные формы
- Окисные соединения
- Коллоидные формирования
- Жидкая фаза
- Марки
Неизвестная история
История открытия олова и его сплавов покрыта пылью времени. Первооткрывателя металла никто не назовет, никто не знает — кто первым догадался переплавить олово с медью. Но известно, что еще 6000 лет назад люди использовали изделия из металла.

Ученые выводят происхождение латинского названия от санскритского sta — forte.
Русское название относится к греческим корням. Alophoys геометрически белый, что указывает на цвет металла.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй групп периодической таблицы. Щелочные металлы первой группы — мягкие, серебристые металлы, хорошо режутся ножом. Все они имеют единственный электрон на внешней оболочке и отлично реагируют. Щелочноземельные металлы второй группы также имеют серебристый оттенок. На внешнем уровне размещены два электрона, и в результате эти металлы менее склонны взаимодействовать с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий К 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Францио Фр 87 | Радио Ра 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаноиды — это группа элементов, изначально присутствующих в редких минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что эти элементы не такие редкие, как предполагалось изначально, и поэтому название лантаноидов было присвоено редкоземельным элементам. Лантаноиды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; Актиниды же радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ас 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Pr 59 | Протаттиний Pa 91 |
| Неодим Nd 60 | Уран U92 |
| Прометий PM 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Curio Cm 96 |
| Тербий Tb 65 | Berkelio Bk 97 |
| Диспрозий Dy 66 | Калифорния Cf 98 |
| Гольмий I 67 | Эйнштейний Ex 99 |
| Эрбий Er 68 | Остановки Fm 100 |
| Тулио ТМ 69 | Менделевий Md 101 |
| Yb 70 | Nobelium n. 102 |
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся во внешней оболочке, поэтому они почти не участвуют в образовании соединений. Эти газы называют «благородными газами», потому что они редко вступают в реакцию с другими элементами; то есть они относятся к представителям благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор FA 9 | Элио Хэ 2 |
| Хлор Cl 17 | Ne 10 неон |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Xe 54 |
| — | Радон Rn86 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электропроводностью и теплопроводностью. Их валентные электроны (с которыми они связываются с другими элементами) находятся в разных электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Cobalt Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Palladio Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Пн 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Renio Re 75 |
| Осмий 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоренцо Lr 103 |
| Rutherfordio Rf 104 |
| Дубний Дб 105 |
| Seaborgio Sg 106 |
| Borio Bh 107 |
| Хасиус Hs 108 |
| Meitnerio Mt 109 |
| Дармштадты Ds 110 |
| Рентгенография Rg 111 |
| Copernicius Cn 112 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, представляют собой полупроводники, используемые для изготовления компьютерных микросхем и печатных схем.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Bb 51 |
| Теллур Те 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, принадлежат к 13-15 группам периодической таблицы. В отличие от металлов они не имеют блеска, но имеют тусклый цвет. По сравнению с переходными металлами, пост-переходные металлы более мягкие, имеют более низкие температуры плавления и кипения и более высокую электроотрицательность. Их валентные электроны, с помощью которых они атакуют другие элементы, находятся только на внешней электронной оболочке. Элементы группы пост-переходных металлов имеют гораздо более высокую температуру кипения, чем неметаллы.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий В 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Олово при низких температурах
Оловянная чума стала причиной трагических событий 1912 года во время экспедиции Скотта на Южный полюс, его путешествие закончилось преждевременно, и виной всему были жестяные крышки топливных баков. В холодном климате температура достигла точки, когда пруд превратился в пыль, и все запасы топлива были потеряны.
Области применения олова
Sn имеет несколько основных применений. Благодаря нетоксичности и устойчивости к коррозии в среде органических солей и кислот этот металл широко используется в пищевой промышленности. Его наносят в виде покрытий на различные продукты, контактирующие с пищевыми продуктами. Медные жилы проводов также покрыты оловом. Он защищает медь от негативного воздействия серы, содержащейся в резиновой изоляции.
В производстве электронных устройств, где для соединения элементов чаще всего применяется пайка, в качестве припоя используется олово.
Sn входит в состав большого количества сплавов с медью, цинком, медью и цинком, медью и сурьмой. Среди самых известных — баббит и бронза.
Электронная схема олова
Sn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2
Краткая запись:
Sn: Kr 5с 2 4д 10 5п 2
Атом олова и Te +2, I +3, X и +4 имеют одинаковую электронную конфигурацию
Порядок заполнения оболочек атома олова (Sn) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6 дней → 7 дней.
На подуровне s может быть до 2-х электронов, на s — до 6, на d — до 10 и на f до 14
В олове 50 электронов, мы заполняем оболочки электронами в описанном выше порядке:
2 электрона на подуровне 1s
2 электрона в подслое 2s
6 электронов в подслое 2p
2 электрона в подслое 3s
6 электронов в подслое 3p
2 электрона на подслое 4s
10 электронов на 3-м подуровне
6 электронов в подслое 4p
2 электрона в подслое 5s
10 электронов на 4-м подуровне
2 электрона на подуровне 5p
Свойства Sn

Stannum (Sn) — это латинское название этого гибкого, пластичного, легкоплавкого металла. Он имеет номер 50 в периодической таблице.
По химическим свойствам металл похож на своих «соседей» — германий и свинец.
В реакциях проявляет степени окисления +2, +4.
Не реагирует ни с водой, ни с воздухом. Причина тому — оксидная пленка на поверхности металла.
Растворяется в разбавленных кислотах; реагирует с неметаллами при нагревании.
Физические свойства пруда:
- плотность β-Sn 7,3 г / см3;
- плотность жидкой жести 6,98 г / см³;
- удельная электропроводность 8,69 МСм / м.
Металл обладает редким свойством: он плавится при низких температурах (232 °) и кипит при высоких (2620 ° С).
Природный водоем содержит 10 стабильных изотопов — это рекорд среди всех элементов таблицы Менделеева.
Свойства атомаИмя, символ, номерАтомная масса(молярная масса)Электронная конфигурацияРадиус атомаХимические свойстваКовалентный радиусИонный радиусЭлектроотрицательностьЭлектродный потенциалСостояния окисленияИонизированная энергия(первый электрон)Термодинамические свойства простого веществаПлотность (до нет.)Температура плавленияТемпература кипенияУд тепло плавленияУд теплота испаренияМолярная теплоемкостьМолярный объемКристаллическая решетка простого веществаРетикулярная структураПараметры решеткиC / a отчетТемпература ДебаяДругие характеристикиТеплопроводностьКоличество CAS
| Олово / олово (Sn), 50 |
| 118,710 (7) 1 эм (г / моль) |
| Кр 4д10 5с2 5п2 |
| 162 вечера |
| 141 вечера |
| (+ 4e) 71 (+2) 93 вечера |
| 1,96 (шкала Полинга) |
| -0,136 |
| +4, +2 |
| 708,2 (7,34) кДж / моль (эВ) |
| 7,31 г / см³ |
| 231,91 ° C 2 |
| 2893 К, 2620 ° С 3 |
| 7.19 2</a>; кДж / моль |
| 296 4 кДж / моль |
| 27,11 4 Дж / (К · моль) |
| 16,3 см³ / моль |
| четырехугольный |
| а = 5,831; с = 3,181 |
| 0,546 |
| 170,00 К |
| (300 K) 66,8 Вт / (м · K) |
| 7440-31-5 |
Аллотропные свойства олова
Аллотропия — это свойство элемента изменять свою кристаллическую решетку при изменении температуры. Модификация альфа (серое олово) устойчива при низких температурах (ниже 13 ° С). У него кубическая решетка, как у алмаза. Практического применения не имеет.
Модификация бета (металлическая белая жесть), из которой сделаны солдатики, тоже закрывает банки. Кристаллическая структура тетрагональная.

Серо-белый оловянный
Металл переходит в гамма-модификацию при температуре 161-232 ° C.
К сожалению: с А.В. Суворовым случилось несчастье. На складе, где хранилась драгоценная коллекция оловянных солдатиков, зимой лопнули трубы отопления, и коллекция просто рассыпалась в пыль.
Маркировка металла
Промышленность выпускает металлы в проволоке, слитках, прутках.
| Степень олова | Форма выпуска, содержание Sn |
| ОВЧ-000 | Допускается не более 0,001% примесей |
| 1пч
1 |
Содержание Sn 99,915%
Примеси не более 0,1% |
| 2 | 99,565% Sn |
| O3 | Содержит 98,49% олова |
| 4 | Самая грязная банка; допустимое содержание примесей до 3,5% |
Свойства атома олова :
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 118,710 (7) а.е.м. (г / моль) |
| 202 | Электронная конфигурация | 1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п2 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O4 P0 Q0 R0
|
| 204 | Радиус атома (рассчитанный) | 145 вечера |
| 205 | Эмпирический радиус атома* | 145 вечера |
| 206 | Ковалентный радиус* | 139 вечера |
| 207 | Ионный радиус (кристаллический) | Sn4+
69 (4) вечера, 83 (18) вечера, 95 (8) вечера (в скобках указано координационное число — характеристика, определяющая количество ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 217 вечера |
| 209 | Электроны, протоны, нейтроны | 50 электронов, 50 протонов, 69 нейтронов |
| 210 | Семья (блок) | член семьи p |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа по периодической таблице | 14 группа (по старой классификации — основная подгруппа 4 группы) |
| 213 | Спектр излучения |  |
Достоинства / недостатки
- Преимущества:
- имеет хорошую коррозионную стойкость в органических кислотах и солях;
- не подвержен негативному влиянию серы, содержащейся в пластике;
- нетоксичен, что позволяет использовать в пищевой промышленности.
- Недостатки:
- имеет низкую температуру плавления;
- склонность к «оловянной чуме”.
Характеристика и физические свойства олова
Олово обладает множеством свойств и вступает в реакцию со многими металлами, неметаллами и другими элементами периодической таблицы. Поэтому рассмотрим общие характеристики вещества:
- Олово способно преобладать в твердом или жидком состоянии, поэтому значения плотности в разных вариантах разные: в первом случае показатель равен 7,3 г / куб. См, во втором — 6,98 7,3 г / куб см.
- Что касается воздействия высоких температур, то стоит отметить, что олово начинает плавиться при 232 ° C, а при температуре 2620 ° C — кипеть.
- Теплопроводность олова в затвердевшем виде составляет 226 Дж / (кг * К), а в жидком виде этот показатель достигает 268 Дж / (кг * К).
- Молярная емкость теплопередачи при стабильном давлении составляет: для белого олова — 27,11 Дж / (моль * К), для серого — 25,79 Дж / (моль * К).
- Теплоотдача при плавлении олова составляет 7,19 кДж / моль, а при испарении — 296 кДж / моль.
- Коэффициент теплопроводности при оптимальной температуре (около 20 ° С) равен 65,26 Вт / (м * К).
- Сопротивление электрического тока колеблется в пределах 0,115 мкОм * м.
- Удельная электропроводность при 20 ° C составляет 8,69 МСм / м.
- Жесткость твердого металла колеблется от 55 ГПа до 48 ГПа в зависимости от температуры от 0 до 100 ° C.
- Предел прочности твердого олова составляет 20 МПа.
- Относительное удлинение — до 40%.
- Твердость серого олова достигает 62 МПа, белого — до 152 МПа.
- Оптимальная температура для литья колеблется от 260 до 300 градусов.
- При нагревании до + 170 ° С пруд приобретает хрупкую структуру.
Особенности структуры, состав и технология производства олова


Типы
Виды припоя олова:
- ПОС-18. Содержит несколько основных компонентов: олово (18%), свинец (около 81), сурьму (2,5%). Применяется для лужения металлов. Подходит для создания швов низкого стандарта. Температура плавления — 270 ° С.
- ПОС-30. Содержит олово (28%), свинец (около 70%), сурьму (2%). Применяется для пайки меди, стали, латуни. Температура плавления — 270 ° С.
- ПОС-50. Содержит олово (50%), свинец (около 50%), сурьму (0,8%). Применяется для сварки радиодеталей, добиваясь качественного шва. Температура плавления — 230.
- ПОС-90. Содержит олово (90%), свинец (9-10%), сурьму (0,15%).
Некоторые виды пайки оловом — ПОС-40, ПОС-60. Их используют для пайки радиодеталей.
Преобладающие формы
Пруд часто встречается в скальных образованиях, заполняющих земную кору. Реже его можно найти из-за образования вулканических пород и других минеральных соединений. Наибольшие запасы элемента преобладают в оксидной форме.
Степень окисления олова
Атомы олова в соединениях имеют степени окисления 4, 2, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, поэтому, если заряд атома виртуально увеличивается, степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, степень окисления положительная.
История открытия и изучения
По археологическим находкам ученым удалось установить, что человечество знало пруд еще в 4 тысячелетии до нашей эры. NS. Письменные записи об этом металле можно найти в четвертой книге Моисея, Библии.
Сначала пруд был недоступен. Его можно было встретить только среди правителей, генералов, зажиточных горожан, купцов. Это был основной компонент оловянной бронзы, появившейся в середине третьего тысячелетия до нашей эры. Так что бронза считалась самым прочным сплавом. Компоненты для его изготовления имели исключительную ценность в эпоху бронзы».
Помимо примесей, в XII веке был получен чистый металл. Об этом упоминается в произведениях Р. Бэкона.
Кристаллическая решётка олова:
| 500 | Кристаллическая решетка | |
| 511 | Кристаллическая решетка # 1 | — пруд (белый пруд) |
| 512 | Ретикулярная структура | Телоцентрированный тетрагональный
|
| 513 | Параметры решетки | а = 5,8197, с = 3,175 |
| 514 | C / a отчет | 0,546 |
| 515 | Температура Дебая | 170 К |
| 516 | Название группы пространств симметрии | I41 / драм |
| 517 | Номер пространственной группы симметрии | 141 |
| 521 | Кристаллическая решетка # 2 | α-олово (серый пруд) |
| 522 | Ретикулярная структура | Кубический алмаз
|
| 523 | Параметры решетки | а = 6,46 |
| 524 | C / a отчет | |
| 525 | Температура Дебая | |
| 526 | Название группы пространств симметрии | Fd_ 3м |
| 527 | Номер пространственной группы симметрии | 225 |
Касситерит
Самый распространенный ресурс олова — касситерит (SnO2). Он поставляется в виде соединения оксида олова с кислородом. Поскольку этот образец является наиболее распространенным минералом, содержащим большой процент олова, первое, на что следует обратить внимание, — это его структура. Если детально изучить образец породы, можно увидеть отдельные кристаллы олова. Они могут достигать в диаметре 3-4 мм, а в некоторых случаях и больше.
КЛАССИФИКАЦИЯ
| Струнц (8-е издание) | 1 / A.05-30 |
| Никель-Струнц (10-е издание) | 1.AC.10 |
| Дана (7-е издание) | 1.1.19.1 |
| Дана (8-е издание) | 1.1.13.1 |
| Привет, CIM Ref | 1,29 |
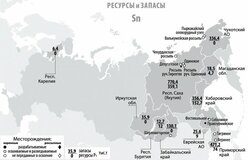
Месторождения оловянных руд
ИЗ. Менделеев писал:
«Олово редко встречается в природе, в жилах древних горных пород, почти исключительно в форме оксида SnO2, называемого оловянным камнем».
Олово — редкий рассеянный металл. В природе среди стихий занимает 47 место по распространенности.
Мировые запасы оловянных руд находятся в:
- Китай;
- Малайзия;
- Индонезия;
- Бразилия;
- Перу;
- Австралия.
Важные российские месторождения оловянных руд сосредоточены на Дальнем Востоке (Приморский край, Якутия, Хабаровский край). Большая часть металла добывается в подземных рудниках.
Основные минералы:
- оловянный камень, касситерит — содержит до 78% металла;

Кристаллы касситерита - олово-пирит (слой), олово 27,5;
- тиллит.
это печально: по подсчетам ученых, оловосодержащие минералы остаются на Земле 30 лет, так что придется выкапывать их из-под обломков или искать замену…
Группы и периоды Периодической системы
Группы называются вертикальными линиями в периодической таблице. В группах элементы объединены в соответствии с наивысшей степенью окисления оксидов. Каждая группа состоит из основной и дополнительной подгрупп. Основные подгруппы включают элементы малых периодов и элементы больших периодов с одинаковыми свойствами. Боковые подгруппы состоят только из элементов больших периодов. Химические свойства элементов основной и второстепенной подгрупп существенно различаются.
Точка — это горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомарных) чисел. В периодической системе семь периодов: первый, второй и третий периоды называются малыми, они содержат 2, 8 и 8 элементов соответственно; остальные периоды называются большими: в четвертом и пятом периодах по 18 элементов, в шестом — 32 и в седьмом (еще незавершенном) — 31 элемент. Каждый период, кроме первого, начинается с щелочного металла и заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: количество протонов в атомном ядре и количество электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Общие сведения:
| 100 | Общая информация | |
| 101 | Имя | Жестяная банка |
| 102 | Прежнее название | |
| 103 | Латинское название | Stannum |
| 104 | Английское имя | Жестяная банка |
| 105 | Условное обозначение | Sn |
| 106 | Атомный номер (номер в таблице) | 50 |
| 107 | Вид | Металл |
| 108 | Группа | Амфотерный, легкий, цветной металл |
| 109 | Открытым | это известно с давних времен. |
| 110 | Год открытия | в XXXV веке до нашей эры |
| 111 | Внешний вид и др. | Податливый, мягкий, пластичный, серебристо-белый, блестящий металл (оловянно-белый, олово) или серый порошок (оловянно-серый, α-олово) |
| 112 | Источник | Натуральный материал |
| 113 | Изменения | |
| 114 | Аллотропные модификации | 4 аллотропные модификации, в том числе.:
— α-олово, олово серое, с кубической кристаллической решеткой алмаза, — — олово белое олово с тетрагональной объемноцентрированной кристаллической решеткой, — -пруд, — -банка |
| 115 | Температурные и другие условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | 2D материалы | |
| 118 | Содержание в атмосфере и воздухе (по весу) | 0 % |
| 119 | Содержится в земной коре (по массе) | 0,00022 % |
| 120 | Содержится в морях и океанах (по массе) | 1,0 10-9 % |
| 121 | Содержится во вселенной и пространстве (по массе) | 4,0 10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0 10-7 % |
| 123 | Содержание метеорита (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по весу) | 0,00002 % |
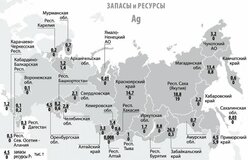
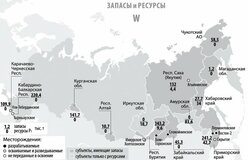
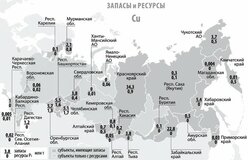
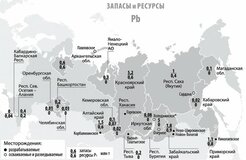
ЗАПАСЫ И ДОБЫЧА

Олово — редкий микроэлемент; олово занимает 47-е место по содержанию в земной коре. Содержание кларка олова в земной коре по разным данным составляет от 2 · 10–4 до 8 · 10–3% по массе. Основная руда олова — касситерит (оловянный камень) SnO2, который содержит до 78,8% олова. Станнин (оловянный пирит) — Cu2FeSnS4 (27,5% Sn) встречается в природе гораздо реже. Мировые месторождения олова в основном находятся в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливия, Перу, Бразилия) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (штокверки Пыркакай; рудник / поселок Валкумей, Иултин — разработка месторождений была закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в г. Хабаровск. Территория (Солнечный район, Верхнебуреинский район (Правоурмийское депо)), в Якутии (Депутатское депо) и другие регионы.
Во время производственного процесса минералосодержащая порода (касситерит) измельчается до среднего размера частиц ~ 10 мм на промышленных мельницах, после чего касситерит, благодаря своей относительно высокой плотности и массе, отделяется от отбракованной породы с помощью вибрации. -гравитационный метод по концентрационным таблицам. Кроме того, применяется флотационный метод обогащения / рафинирования полезных ископаемых. Таким образом, можно увеличить содержание олова в руде до 40-70%. Затем концентрат обжигают в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды плавится в печах. В процессе плавки его возвращают в свободное состояние с помощью восстановительного древесного угля, слои которого поочередно накладываются друг на друга со слоями минерала или алюминия (цинка) в электрических печах: SnO2 + C = Sn + CO2. Олово высокой чистоты полупроводника получают электрохимическим рафинированием или зонной плавкой.
ПРИМЕНЕНИЕ

Олово в основном используется в качестве безопасного, нетоксичного и устойчивого к коррозии покрытия, как отдельно, так и в виде сплава с другими металлами. Основное промышленное применение олова — это белая жесть (луженое железо) для изготовления пищевых контейнеров, пайка электроники, бытовые трубы, подшипниковые сплавы и покрытия из олова и его сплавов. Самый важный сплав олова — бронза (с медью). Другой известный сплав — олово — используется для изготовления посуды. На эти цели расходуется около 33% всего добытого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (несущий сплав или баббит), с цинком (упаковочный лист) и в виде олова-свинца и олова припои цинковые. В последнее время наблюдается возрождение интереса к использованию металла, так как это самый «зеленый» из тяжелых цветных металлов. Он используется для создания сверхпроводящих проводов на основе интерметаллида Nb3Sn.
Дисульфид олова SnS2 используется в составе красок, имитирующих позолоту («сусальное золото»).
Искусственные радиоактивные ядерные изомеры олова 117mSn и 119mSn — источники гамма-излучения, являются мессбауэровскими изотопами и используются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония имеют высокие температуры плавления (до 2000 ° C) и стойкость к окислению при нагревании на воздухе и имеют множество применений.
Олово — важнейший легирующий компонент при производстве конструкционных титановых сплавов.
Диоксид олова — очень эффективный абразивный материал, используемый для «очистки» поверхности оптического стекла.
Смесь солей олова — «желтый состав» — раньше использовалась в качестве красителя для шерсти.
Олово также используется в химических источниках тока в качестве анодного материала, например: элемент марганец-олово, элемент оксид-ртуть-олово. Перспективно использование олова в свинцово-оловянных батареях; поэтому, например, при том же напряжении, по сравнению со свинцово-кислотной батареей, свинцово-оловянная батарея имеет в 2,5 раза большую емкость и в 5 раз более высокую плотность энергии на единицу объема, ее внутреннее сопротивление очень низкое.
Исследованы изолированные двумерные слои олова (станена), созданные по аналогии с графеном.
Олово — Sn
| Молекулярный вес | 118,71 г / моль |
| Происхождение названия | от wed древневерхненемецкое elo — «желтый», lat albus — «белый», поэтому металл получил свое название от цвета |
| Статус IMA | действителен, впервые описан до 1959 г. (до IMA) |
Минерал Станнин
Олово пирит — второе название этого минерала, относящегося к классу сульфидов. Это самый распространенный источник олова в России. Процент желаемого металла от 10 до 40%. При увеличении этой доли могут наблюдаться признаки разложения пласта, сопровождающиеся выделением касситерита.
Валентность Sn
Атомы олова в соединениях имеют валентность IV, II.
Валентность олова характеризует способность атома Sn образовывать химические связи. Валентность происходит от структуры электронной оболочки атома, электроны, участвующие в образовании химических соединений, называются валентными электронами. Более широкое определение валентности:
У Валентности нет никаких признаков.
ПРОИСХОЖДЕНИЕ

Основная форма нахождения водоемов в горных породах и минералах — рассеянная (или эндокриптовая). Однако олово также образует минеральные формы, и в этой форме оно часто встречается не только как вспомогательное вещество в кислых магматических породах, но также образует промышленные концентрации, главным образом в оксидных (касситерит SnO2) и сульфидных (станнин) формах.
В целом в природе встречаются следующие формы водоема:
- Диффузная форма: конкретная форма олова в этой форме неизвестна. Здесь можно говорить об изоморфно диспергированной форме олова из-за наличия изоморфизма с несколькими элементами (Ta, Nb, W — с образованием типично кислородсодержащих соединений; V, Cr, Ti, Mn, Sc — с образованием кислорода и соединения серы). Если концентрация олова не превышает некоторых критических значений, оно может изоморфно замещать названные элементы. Механизмы изоморфизма разные.
- Минеральная форма: олово содержится в концентрации минералов. Как правило, это минералы, в которых присутствует железо Fe + 2: биотиты, гранаты, пироксены, магнетиты, турмалины и др. эта связь обусловлена изоморфизмом, например, по схеме Sn + 4 + Fe + 2 → 2Fe + 3. В оловосодержащих скарнах высокие концентрации олова обнаруживаются в гранатах (до 5,8% по массе) (особенно в андрадитах), эпидоты (до 2,84% по массе) и т д
В сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова обнаружены в грейзен-пирротине Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит разложение твердых растворов с микровыделениями Cu2 + 1Fe + 2SnS4 или тиллита PbSnS2 и других минералов.
Сплавы
По своей классификации оловянные сплавы делятся на припои, подшипники и предохранители.
- Бабби. К ним добавлены свинец, медь, сурьма. Баббиты могут иметь легирующие добавки. Маркировка баббита: B88, B83, B83S.
- Бронза — это сплав меди и олова. Любая бронза содержит небольшие добавки фосфора, цинка, свинца, никеля и других элементов. Марки бронзы: Бр ОФ 6,5-0,15; Пт. ОТС 4-3; Бр.ОЦ10-2; FR.OF 10-1; Бр.ОНС 11-4-3.
- Оловянный. Сплав с висмутом, сурьмой, медью, иногда со свинцом.
- Сварщики. Есть жесткие и предохранители. В сплав добавляют свинец и другие элементы. Марки сварки: ПОС-30, ПОС-40, ПОС-90.
Плюсы и минусы олова
Преимущества включают:
- Нетоксичен, это позволяет использовать металл в пищевой промышленности, при производстве посуды.
- Хорошая устойчивость к коррозии в агрессивных средах.
- Не реагирует с серой; поэтому они используются везде, где металл «обернут» резиновыми или пластиковыми изоляторами.
Недостатки:
- Восприимчив к «чуме пруда».
- Достаточно высокая стоимость ограничивает широкое использование металла.
- Низкая температура плавления (всего 232 ° C).
Квантовые числа Sn
Квантовые числа определяются последним электроном в конфигурации; для атома Sn эти числа имеют значение N = 5, L = 1, Ml = 0, Ms = ½

Производство изделий из олова и его сплавов
Оловянные изделия пользовались спросом с давних времен. Дети играют в оловянных солдатиков уже 4000 лет.
Познавательно: в музеях Санкт-Петербурга хранятся большие коллекции оловянных солдатиков.
- Электроника с ее платами теперь повсюду, а все контакты соединены пайкой олова и его сплавов. Для медных проводов полезно лужение, это защита от воздействия серы (она входит в состав резиновой изоляции).
- Сплавы баббита с оловом обладают отличными антифрикционными свойствами. Ни один из механизмов (от велосипеда до могучего КрАЗа) не обходится без подшипников.
- Металл используется в сплаве для высокой печати. Печатное производство невозможно без оловянных сплавов.

Расплавленное олово Влияние на организм оловянных изделий минимально. Поэтому использование металла в пищевой промышленности вполне оправдано.
Простая консервная банка и гибель полярной экспедиции
Французский шеф-повар Франсуа Аппер открыл, как сохранять пищу надолго. Он предложил герметично запечатать продукты в жестяных банках (это тонкий лист железа, покрытый оловянным напылением). Сейчас мы не можем представить жизнь без баночки вкусных консервов.
Но сами банки (а точнее, «оловянная чума») способствовали гибели экспедиции Р. Скотта на Южный полюс: из спаянных оловянных цистерн протекало топливо. Металл перешел в альфа-модификацию и рассыпался на морозе.
Энергия ионизации
Чем ближе электрон к центру атома, тем больше энергии требуется, чтобы разорвать его на части. Энергия, затрачиваемая на отделение электрона от атома, называется энергией ионизации и обозначается Eo. Если не указано иное, энергия ионизации — это энергия отделения первого электрона; есть также энергии ионизации для каждого последующего электрона.
Силикаты
Еще один распространенный оловосодержащий минерал — малахит. Он принадлежит к классу силикатов, способных образовывать огромные месторождения металлов.
Формирование и виды осадочных пород
Как природный материал, олово содержится не только в различных минералах и горных породах, но и в других источниках в виде различных соединений.
Промышленное получение
Существует две технологии промышленного производства олова:
- Редукционное слияние. Для осуществления данной технологии используются 2 типа устройств: отражательные печи, горное оборудование для плавки.
- Утонченность. Он термический, электролитический.
Нахождение в природе
Чаще всего водоем встречается в скалах в виде разрозненных форм. Но в кислых формациях минерал встречается в виде минеральных включений и залежей касситерита, что представляет интерес для промышленного производства.
Формы веществ, содержащихся в природе:
- минеральные включения;
- оксидные соединения;
- коллоидные формы;
- жидкие фазы.

Разрозненные отложения не отличаются определенной формой содержания. Наблюдаются изоморфные конкреции сульфида и кислорода. В месторождениях первого типа олово представлено сфалеритами, халькопиритами, пиритами. В результате распада появляются элементы тилита и других минералов. В России изоморфные дисперсии обнаружены в Приморье, например на Дубровском и Смирновском месторождениях.
Минеральные формы
В группу входят самородки и сплавы интерметаллических образований. Концентрации в почве низкие, но эти отложения сконцентрированы на больших площадях. Наряду с оловом есть минералы меди, алюминия, железа, не говоря уже о характерных самородках серебра, золота и платиноидов.
В образовании оловянных сплавов участвуют те же элементы:
- нападет;
- стистит;
- звягинцевит;
- бури.
Эти образования встречаются в интрузивных магниевых породах, например в пикритах и ловушках на сибирском шельфе. Габброиды и гипербазы встречаются в почвах Камчатки. Гидротермальные и метасоматические породы встречаются в никелевых и медных рудах бассейнов Урала, Узбекистана и Кавказа. Пелагические осадочные образования — результат Великого Толбачинского извержения.
Окисные соединения
Чаще всего встречается в природе в виде касситеритов (Sn O 2), которые представляют собой оксиды олова. Гамма-резонансная томография показывает присутствие Sn + 4. Соединения содержат до 78% олова в виде сплошных вкраплений с отдельными зернами минерала размером 3-5 мм.
Различают формы касситерита:

- Сплавы гидроксидов в природе представлены осадками полиоловых кислот. К ним относятся сукулайты, варламовиты, гидромартиты и гидростанаты.
- Силикаты представлены малаитами, стоказитами, пабститами. Первый тип полезных ископаемых встречается в больших масштабах.
- Сульфидные образования металла представлены серой в сочетании с оловом и являются второй по важности группой для промышленного развития. Более сложные соединения содержат медь и свинец. Халькопириты чаще встречаются в горных породах.
- У Станнинов есть второе название оловянного пирита. Полезные ископаемые широко добываются в Якутии и Приморье. Во многих случаях это основа образования халькопирита.
Касситерит — отличный материал для изготовления чистого олова. В России их добывают в Забайкалье, разрабатывают в регионах Средней Азии. Бассейны мира находятся в Таиланде, Боливии, Малайзии, Китае, Индонезии, Нигерии.
Коллоидные формирования
Кремний-коллоидные формы играют важную роль в геохимических процессах, хотя их детальное изучение не проводилось. Соединения относятся к вязкой форме выражения коломорфных касситеритов, которые претерпевают кристаллические превращения. Сильная растворимость олова в композициях хлорида кремния.
Анализ характеристик соединений и их сходства с Si (OH) 4 показывает возможность получения материала с высокой молекулярной массой (полимером) путем добавления олигомеров и мономеров к активным молекулам. В результате появляется соединение с заменой группы ОН на анионы хлора и фтора. Полимеризация приводит к образованию диспергированного геля. Эта форма относится к промежуточным этапам отделения осадков от гидротермальных веществ.

Жидкая фаза
В газообразных и жидких образованиях горных пород касситериты выделены в категорию заключенных минералов. Природные растворы с включением олова практически не анализировались, информация была получена экспериментальными методами исследования.
Типы олова, содержащегося в природных жидкостях, делятся на категории:
- Ионные соединения. Их структура изучена с точки зрения валентных связей и стереохимических комбинаций. Есть подкатегории ионов, галогенидов, гидроксилов и сульфидных образований.
- Сложные образования. Их получают травлением касситеритов в среде с высокой концентрацией фтора или хлора.
Олово: включения кремния и геля, диспергированные в естественной жидкой среде, встречаются редко. Минеральные материалы — основа этих форм. Соединения проявляют свойства слабых оснований в кислых породах.
Марки
Торговая марка:
- О1, О1пч. Это обозначение указывает на то, что сплав содержит 99,9% Sn. Изготавливается в виде проволоки, прутков, слитков.
- OHCH-000. Сплав высокой чистоты. Содержание Sn в составе 99,99%. Изготавливается в виде прутков, слитков.
- O2. Содержание Sn в составе 99,565%. Выпускается в виде прутков, проволоки, слитков.
- O3. Сплав содержит 98,49% Sn. Изготавливается в слитках.
- O4. Самая «грязная» связь. Содержит большое количество сторонних примесей. Их примерное количество — 3,5% от общей массы.
Маркировка наносится на готовую продукцию посредством штампа.
- https://TheMineral.ru/metally/olovo
- [https://himi4ka.ru/tablica-mendeleeva]
- [https://tdpromtech.ru/czvetnoj-metalloprokat/olovo.html]
- [https://www.metotech.ru/olovo-opisanie.htm]
- [https://aspektcenter.ru/periodicheskaya-tablitsa-mendeleyeva-olovo/]
- [https://ChemicalStudy.ru/olovo-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/]
- [https://metalloy.ru/metally/olovo]
- [https://mineralpro.ru/minerals/tin/]
- [https://nauka.club/khimiya/olovo.html]
Читайте также: Температура плавления металлов: таблица по возрастанию в градусах, самая высокая температура плавления